模版一:
·临床研究·
不同频率重复经颅磁刺激对脑梗死患者上肢功能的影响*
沈 滢1 单春雷1 殷稚飞1 孟殿怀1 侯 红1 戴文骏1 励建安1,2
DOI:10.3969/j.issn.1001-1242.2012.期数.文章编号(如:001)
*基金项目:江苏省医学重点学科(实验室)——江苏省人民医院康复医学科开放课题资助项目(XK201110);江苏省卫生厅“科教兴卫工程”项目(XK20 200903)
1 南京医科大学第一附属医院康复医学中心,210029; 2 通讯作者
作者简介:沈滢,女,硕士,主管治疗师; 收稿日期:2012-08-28
摘要
目的:比较不同频率的重复经颅磁刺激(rTMS)对脑梗死患者上肢功能的影响。
方法:将30例患者随机分为0.5Hz组、1Hz组和2Hz组,常规药物治疗和康复训练基础上对健侧大脑皮质M1区进行不同频率(0.5Hz、1Hz、2Hz)的rTMS治疗,持续治疗20d,于治疗前、治疗10d及20d时对各组患者进行疗效评定,采用上肢Fugl-Meyer评分法、上肢运动力指数(MI)、偏瘫上肢功能测试(香港版)对患者上肢功能进行评定,同时检测各组患侧脑区运动诱发电位(MEP)皮质潜伏期及中枢运动传导时间(CMCT)。
结果:①上肢功能变化:治疗后3组上肢功能均明显提高,治疗10d时,0.5Hz组上肢MI评分明显高于2Hz组(P<0.05),1Hz组与其他两组组间差异无显著性意义(P>0.05);治疗20d时,0.5Hz组各项评分均优于2Hz组(P<0.05),1Hz组上肢MI评分优于2Hz组(P<0.05),0.5Hz组与1Hz组组间差异不具有显著性意义(P>0.05)。②神经电生理学变化:治疗后3组MEP皮质潜伏期及CMCT均较治疗前明显缩短,治疗10d时,0.5Hz组CMCT明显短于2Hz组(P<0.05);1Hz组与其他两组组间差异无显著性意义(P>0.05);治疗20d时,0.5Hz组MEP皮质潜伏期明显短于2Hz组(P<0.05),CMCT明显短于1Hz组和2Hz组(P<0.05);1Hz组CMCT较2Hz组缩短明显(P<0.05)。
结论:0.5Hz或1Hz的重复经颅磁刺激作用于脑梗死患者健侧半球均可明显提高患侧脑区运动皮质的兴奋性,促进患侧上肢功能的恢复,且0.5Hz的刺激频率对提高患侧运动皮质的兴奋性最有效。
关键词 重复经颅磁刺激;脑梗死;上肢功能;运动诱发电位
中图分类号:R743.3,R493 文献标识码:A 文章编号:1001-1242(2012)---
Effect of different frequencies in repetitive transcranial magnetic stimulation for upper limb function in patients with cerebral infarction/SHEN Ying, SHAN Chunlei, YIN Zhifei, et al.//Chinese Journal of Rehabilitation Medicine, 2012,27():
Abstract
Objective: To compare the effect of different frequencies in repetitive transcranial magnetic stimulation (rTMS) for upper limb function in patients with cerebral infarction.
Method: Thirty patients were randomly assigned to three groups receiving 0.5Hz, 1Hz, and 2HzrTMS on the unaffected hemisphere for 20 days, respectively. Over the same period, all patients were also treated with conventional medical treatment and rehabilitation training. The treatment effectiveness was assessed by upper limb function scales using FMA, MI and FTHUE-HK, as well as the MEP cortical latency and CMCT in the affected brain area. The evaluation was performed before and at the 10th and 20th days over the treatment. Statistic difference was assigned at P<0.05.
Result: Upper limb function improved in all 3 groups after the treatment. At the 10th day of the treatment, the 0.5Hz group exhibited significantly higher MI score compared with the 2Hz group. All other indices were not statistically different among the three groups. At the 20th day of the treatment, the 0.5Hz group showed superior scores for all indices compared with those of the 2Hz group. The indices of the 1Hz group fell in the middle of the other two groups. No statistical significance was observed except for a higher MI score compared with the 2Hz group. The cortical latency of MEP and CMCT of the 3 groups reduced after the treatment. At the 10th day, CMCT of the 0.5Hz group is significantly shorter than the 2Hz group. There was no statistical between group 1Hz and the other two groups (P>0.05). At the 20th day, CMCT in both the 0.5Hz and 1Hz group were significantly shorter than that in the 2Hz group. Cortical latency of MEP in both groups was also shorter than that in the 2Hz group, with statistical significance observed only for the 0.5Hz group.
Conclusion: rTMS on the unaffected hemisphere of the patients with cerebral infarction improves the excitability of the motor cortex of the affected brain area and promotes the recovery of upper limb function. Compared with 1Hz and 2Hz, 0.5Hz provides the most effective treatment.
Author's address Dept. of Rehabilitation Medicine, First Affiliated Hospital of Nanjing Medical University, 210029
Key word repetitive transcranial magnetic stimulation; cerebral infarction; upper limb function; motor evoked potential
重复经颅磁刺激(repetitive transcranial magnetic stimulation, rTMS)是一种无创、无痛刺激大脑皮质的技术。近年来,已逐渐成为改善脑卒中后上肢功能障碍的有效方法之一[1]。rTMS的刺激参数很多,不同的参数设置会产生不同的效果。关于不同频率之间的疗效及副作用差别,很多研究都是将健侧半球低频刺激与患侧半球高频刺激做对比,结果大多认为脑梗死后健侧半球1Hz的低频rTMS疗效最好且最安全[2]。此类研究本质上是探讨脑梗死后rTMS刺激靶点的最佳半球。然而,在脑梗死的治疗中健侧和患侧rTMS各自的最佳刺激参数尚无定论,这就导致了一些研究结果的不一致。最佳刺激参数的确定是深入研究rTMS疗效的重要前提。本研究旨在研究健侧半球rTMS的频率对脑梗死患者上肢功能康复的影响,为rTMS治疗脑梗死的深入研究和临床应用提供依据。
1 资料与方法
1.1 病例资料
选取2012年1—8月间在南京医科大学第一附属医院康复医学中心治疗的脑梗死患者30例。
1.1.1 入选标准:①符合1995年第四届全国脑血管病学术会议制定的《脑血管病诊断标准》中的脑梗死诊断标准[3];②初次、单侧发病或虽既往有发作但未遗留有神经功能障碍;③生命体征稳定,意识清晰;④患侧上肢Brunnstrom评级:Ⅱ-Ⅳ级;⑤年龄20—85岁;⑥病程1年以内;⑦可测出患侧脑区运动诱发电位;⑧入选者可自己本人签署知情同意书。
1.1.2 排除标准:①有癫痫病史、一级亲属中有特发性癫痫病史及使用致痫药物;②心、肺、肝、肾等重要脏器功能减退或衰竭;③严重认知及交流障碍而不能配合;④戴有起搏器、颅内有金属植入物,或有颅骨缺陷;⑤有严重颈椎病变包括严重颈椎管狭窄、颈椎不稳定;⑥颈内动脉完全闭塞;⑦主要运动皮质区的直接损伤;⑧妊娠期妇女。
1.1.3 一般资料:采用随机数字表法将上述患者分为0.5Hz组、1Hz组及2Hz组,每组10例。3组患者一般情况及病程见表1,表中数据组间差异均无显著性意义(P>0.05),具有可比性。
.jpg)
1.2 治疗方法
3组患者均给予常规药物治疗和康复训练,同时对健侧大脑皮质M1区进行不同频率的rTMS,磁刺激器为武汉依瑞德公司的YRD CCY-I型经颅磁刺激仪,最大磁场强度3T,圆形线圈。施加刺激时,使圆形线圈与颅骨表面相切,寻找可引发健侧肢体拇短展肌最大运动诱发电位(motor evoked potential, MEP)波幅的位置,即“运动热点”[4],将线圈中心对准该点,手柄垂直指向枕侧。三组治疗参数均采用90%运动阈值(motor threshold, MT)强度,每个序列脉冲8个,间歇时间3s,根据刺激频率分组为:①0.5Hz组:每个序列刺激持续时间16s,重复48个序列,脉冲总数384个;②1Hz组:每个序列刺激持续时间8s,重复82个序列,脉冲总数656个;③2Hz组:每个序列刺激持续时间4s,重复129个序列,脉冲总数1032个。3组治疗时间均为15min/次,1次/d,连续治疗20d。
1.3 评定方法
治疗前、治疗10d及治疗20d时,分别评定每组患者偏瘫上肢功能和患侧脑区的神经电生理学指标,具体方法如下。
1.3.1 上肢功能。
1.3.1.1 上肢Fugl-Meyer评分[5]:上肢运动功能部分包括反射、肩、肘、腕、手等9大项,33个小项,分级为3级(0—2分),总积分为66分。
1.3.1.2 上肢运动力指数(motricity index, MI)[6]:包括抓捏动作、屈肘动作、外展肩关节动作三个项目,每个项目满分为33分,整个上肢分值是三个项目的积分加1,功能正常应为100分。
1.3.1.3 偏瘫上肢功能测试(香港版)(Hong Kong edition of functional test for the hemiplegic upper extremity, FTHUE-HK): 偏瘫上肢功能测试是由Wilson等在1984年设计的,用来评价脑卒中患者在恢复期间日常生活任务中使用上肢的能力,而FTHUE-HK则考虑了中国人的手部功能,做了一部分调整,其信度和效度均较好[7]。且国内已有文献报道使用该量表[8]。共12个测试项目,最高级别为七级。
1.3.2 神经电生理学检查。
1.3.2.1 MEP皮质潜伏期:在受试者患侧大脑M1区给予阈上强度的TMS,在对侧拇短展肌记录MEP,取重复性好波幅较大的五条波形,记录其潜伏期值,并取平均值,即为在拇短展肌记录的皮质潜伏期。
1.3.2.2 中枢运动传导时间(central motor conduction time,CMCT):将磁刺激线圈置于受试者患肢同侧第7颈椎棘突旁,给予阈上强度的TMS,再记录MEP,取重复性好波幅较大的五条波形,并取平均值,即为在拇短展肌记录的脊髓潜伏期。计算CMCT,即皮质运动区和脊髓TMS刺激诱导的MEP潜伏期之差[9]。
1.4 统计学分析
采用SPSS19.0版统计学软件包进行数据分析,组内及组间均数比较采用单因素方差分析,如有显著性差异,进一步用最小显著差法(the least significant difference,LSD)法进行多重比较,P<0.05表示差异具有显著性意义。
2 结果
2.1 上肢功能
治疗前各组患者上肢量表评分(表2)组间差异均无显著性意义(P>0.05)。治疗10d时, 0.5Hz组的评分较治疗前显著提高(P<0.05),且上肢MI评分明显高于2Hz组(P<0.05),1Hz组上肢Fugl-Meyer和MI评分较治疗前也有所改善(P<0.05)。治疗20d时0.5H组与1Hz组评分均较治疗前显著提高(P<0.05),0.5Hz组三项上肢量表评分均优于2Hz组(P<0.05),1Hz组MI评分优于2Hz组(P<0.05),0.5Hz组与1Hz组间差异不显著(P>0.05)。2Hz组治疗前后变化不显著(P>0.05)。
2.2 神经电生理指标
治疗前各组患者MEP皮质潜伏期及CMCT的数值(表3)均无显著差异(P>0.05)。治疗10d时,0.5Hz组MEP皮质潜伏期及CMCT较治疗前显著缩短(P<0.05),1Hz组CMCT较治疗前明显缩短(P<0.05),0.5Hz组和1Hz组组间差异不显著(P>0.05),但是0.5Hz组CMCT明显短于2Hz组(P<0.05)。治疗20d时,0.5Hz组和1Hz组MEP皮质潜伏期及CMCT均较治疗前显著缩短(P<0.05),0.5Hz组MEP皮质潜伏期明显短于2Hz组(P<0.05),0.5Hz组CMCT明显短于1Hz组和2Hz组(P<0.05),1Hz组CMCT也较2Hz组明显缩短(P<0.05)。2Hz组治疗前后变化不显著(P>0.05)。
.jpg)
.jpg)
3 讨论
3.1 rTMS的适宜频率值得研究
现有文献中对促进脑梗死上肢功能恢复健侧半球rTMS频率几乎都是选择1Hz,且已证明健侧1Hz的rTMS可有效改善运动功能,而刺激强度基本都采用阈下刺激(≤100%MT)[2]。而rTMS在脑梗死后偏侧忽略、失语症的治疗中健侧半球刺激的频率选择范围已扩展到0.5Hz[10—11]。目前为止,没有研究比较过健侧半球不同频率的rTMS(≤100%MT)对脑梗死上肢功能的影响。本研究在1Hz阈下刺激对脑梗死上肢功能恢复有效的基础上,将频率的选择范围扩大,增加了0.5Hz和2Hz组,探讨这两种频率是否同样有效或疗效更好,旨在探索健侧半球rTMS的适宜频率范围,为寻找最佳刺激频率的研究提供依据。
3.2 rTMS的最适宜频率可能低于文献报告
本研究发现,0.5Hz组和1Hz组患者经治疗后上肢功能均显著改善,且疗效优于2Hz组。治疗10d时,1Hz组虽上肢Fugl-Meyer和MI评分较治疗前明显提高(P<0.05),但FTHUE-HK评分变化不显著(P>0.05),这可能是由于FTHUE-HK分级针对的是脑卒中患者上肢总体功能的恢复,分级的提高比单纯Fugl-Meyer评分的提高难度要大[8]。为了对运动功能进行客观定量的检查,我们使用了经颅磁刺激运动诱发电位技术,它可以无创性检查锥体束运动功能,检测运动神经系统皮质神经元和脊髓神经元的兴奋性。MEP可反映中枢运动传导通路的功能,能够比临床功能指标更加客观,可靠的反映运动神经元的损害程度,为脑卒中患者运动功能的预后提供重要的临床信息[12]。缺血性脑卒中患者受损半球MEP皮质潜伏期和CMCT均有所延长,且MEP皮质潜伏期及CMCT与神经功能缺损的严重性呈正相关[13]。Barker等[14]的研究表明损伤对侧肢体MEP潜伏期的下降与上肢功能的改善呈正相关。本研究也得出了相同的结论,治疗前三组患者MEP皮质潜伏期和CMCT均较正常值有所延迟。治疗后0.5Hz组与1Hz组MEP皮质潜伏期和CMCT较治疗前明显缩短(P<0.05),与这种改变相对应的是两组患者上肢功能均较治疗前明显提高(P<0.05),而2Hz组MEP皮质潜伏期和CMCT虽有缩短的趋势,但与其上肢功能指标一样,与治疗前差异不显著(P>0.05)。CMCT反映的是MEP在颅内传导时间,所以比MEP皮质潜伏期更能直接反映大脑皮质兴奋性的情况,更能准确的评估疾病进程和预后。0.5Hz组和1Hz组CMCT在治疗20d时明显短于2Hz组(P<0.05),且0.5Hz组CMCT缩短程度比1Hz组好(P<0.05)。说明当刺激频率为0.5Hz时,rTMS能更好地提高患侧皮质的兴奋性。而本研究中在治疗20d时0.5Hz组与1Hz组虽在CMCT上有差异(P<0.05),但两组上肢功能的差异不明显(P>0.05),这可能是和样本量较小或治疗时间过短有关。研究结果表明,频率为0.5Hz或1Hz的低频rTMS作用于脑梗死患者健侧半球均可明显提高患侧脑区运动皮质的兴奋性,促进上肢功能的恢复,且0.5Hz的刺激频率对提高患侧半球运动皮质的兴奋性最有效。在相同的治疗时间里,0.5Hz组患者所接受的磁刺激脉冲总数几乎为1Hz组的1/2,为2Hz组的1/3,因此0.5Hz组患者接受的磁刺激最少,患者更容易耐受。本研究为rTMS在脑梗死治疗中找到了比1Hz更有效的频率,且0.5Hz的rTMS更安全,在治疗中可优先考虑。
3.3 低频磁刺激的作用机制
虽然健侧半球0.5Hz的rTMS对提高患侧皮质兴奋性效果最好,但其作用机制未明,可能与以下因素有关:①0.5Hz的rTMS对健侧皮质的抑制作用或调节半球间抑制(interhemispheric inhibition,IHI)路径平衡的作用较强。正常状态下人体大脑双侧半球皮质存在一种程度相似的经胼胝体的相互抑制,即IHI[15]。脑卒中后大脑两半球间这一抑制路径的平衡被打破,表现为患侧半球皮质兴奋性的降低和健侧半球皮质兴奋性的增高,这将阻碍运动功能的恢复。因此,可通过降低健侧半球M1区的兴奋性来纠正脑卒中后大脑半球间过度的相互抑制[2]。已有研究表明≤1Hz的低频rTMS能降低运动皮质的兴奋性[16],可作用于脑梗死的健侧半球,且这种抑制性的rTMS并不会影响刺激对侧健手的功能[17]。宋为群等[10]报道了0.5Hz的rTMS作用于脑卒中患者健侧半球顶叶后部可以有效地改善视觉空间忽略症状,该研究支持注意网络的半球竞争理论,认为健侧顶叶后部0.5Hz的低频rTMS,降低了健侧顶叶活动水平,达到新的平衡状态。②0.5Hz组刺激持续时间最长,对运动皮质产生了较强的抑制效应。Jung等[4]报道了作用于健康人大脑皮质M1区10Hz的高频rTMS对运动皮质兴奋性的改变与刺激的持续时间有关,当刺激持续时间为1.5s时,刺激侧MEP的波幅增大;而当刺激持续时间为5s时,刺激侧和刺激对侧MEP的波幅反而降低,说明随着刺激持续时间的延长,即使高频刺激也可能对运动皮质的兴奋性产生抑制作用。rTMS的刺激参数较多,频率的变化会引起其他相关参数的改变,本研究中三组采用了不同的频率,在保证每个序列脉冲个数相同的情况下所用的刺激持续时间不同,0.5Hz组每次刺激持续时间时间最长,为16s,是1Hz组的2倍,2Hz组的4倍。③0.5Hz的rTMS治疗可以改善脑缺血大鼠的神经功能,并导致健侧突触结构参数的改变,使突触界面曲率、突触后致密物质厚度增加,突触间隙变窄而使健侧突触传递功能增强,表明了0.5Hz的rTMS可促进健侧脑的代偿作用[18]。
3.4 研究的局限
rTMS的刺激参数较多且作用机制较为复杂,不同的参数组合可能会产生不同的效果,给最佳刺激参数的研究带来很大的困难。本研究得出健侧半球0.5Hz的rTMS比1Hz的rTMS能更好地提高患侧半球运动皮质兴奋性,但由于样本量较小、观察时间较短等原因,0.5Hz组上肢功能的改善程度与1Hz组差异不显著。今后有必要观察rTMS对脑梗死治疗的长期效应,并制定适宜的疗程。对于频率的研究,还需要进一步的深入,探讨0.5Hz以下频率的疗效,以期找到最佳频率。此外,刺激的持续时间、间歇时间以及脉冲总数等对疗效的影响以及rTMS对不同病程、不同功能分级患者的疗效是否有差别、如何达到最佳化,也有待进一步研究。
参考文献
[1] Emara TH, Moustafa RR, Elnahas NM, et al. Repetitive transcranial magnetic stimulation at 1Hz and 5Hz produces sustained improvement in motor function and disability after ischaemic stroke[J]. Eur J Neurol,2010,17(9):1203—1209.
[2] Hoyer EH, Celnik PA. Understanding and enhancing motor recovery after stroke using transcranial magnetic stimulation[J]. Restor Neurol Neurosci,2011,29(6):395—409.
[3] 中华神经内科学会,中华神经外科学会.各类脑血管疾病的诊断要点[J].中华神经科杂志,1996,29(6):379—381.
[4] Jung SH, Shin JE, Jeong YS, et al. Changes in motor cortical excitability induced by high-frequency repetitive transcranial magnetic stimulation of different stimulation durations[J]. Clin Neurophysiol,2008,119(1):71—79.
[5] Gladstone DJ, Danells CJ, Black SE. The Fugl-Meyer assessment of motor recovery after stroke: a critical review of its measurement properties[J]. Neurorehabil Neural Repair,2002,16(3):232—240.
[6] Kong KH, Chua KS, Lee J. Recovery of upper limb dexterity in patients more than 1 year after stroke: Frequency, clinical correlates and predictors[J]. NeuroRehabilitation,2011,28(2):105—111.
[7] Fong K, Ng B, Chan D, et al. Development of the Hong Kong version of the functional test for the hemiplegic upper extremity (FTHUE-HK). Hong Kong Journal of Occupational Therapy,2004,14(1):21—29.
[8] 邹智,张英,王珊珊,等. 镜像治疗结合任务导向性训练对脑卒中患者上肢功能的影响[J].中华物理医学与康复杂志,2011,33(9):693—696.
[9] 马玉娟, 黄杰, 方征宇,等. 高频重复经颅磁刺激对脑梗死大鼠运动诱发电位皮质潜伏时和中枢运动传导时间的影响[J].中国康复医学杂志,2011,26(10):898—902.
[10] 宋为群,李永忠,杜博琪,等. 低频重复经颅磁刺激治疗视觉空间忽略的临床研究[J]. 中国康复医学杂志,2007,22(6):483—486.
[11] 陈升东,于苏文,赵建法,等. 重复经颅磁刺激联合多奈哌齐治疗脑梗死失语的疗效观察[J]. 中华物理医学与康复杂志,2012,34(3):212—215.
[12] Jang SH, Ahn SH, Sakong J, et al. Comparison of TMS and DTT for predicting motor outcome in intracerebral hemorrhage[J].J Neurol Sci,2010,290(1-2):107—111.
[13] Stulin ID, Savchenko AY, Smyalovskii VE,et al. Use of transcranial magnetic stimulation with measurement of motor evoked potentials in the acute period of hemispheric ischemic stroke[J].Neurosci Behav Physiol,2003,33(5):425—429.
[14] Barker RN, Brauer SG, Barry BK, et al. Training-induced modifications of corticospinal reactivity in severely affected stroke survivors [J].Exp Brain Res,2012,221(2):211—221.
[15] Kirton A, Chen R, Friefeld S, et al. Contralesional repetitive transcranial magnetic stimulation for chronic hemiparesis in subcortical paediatric stroke:a randomised trial[J].Lancet Neurol,2008,7(6):507—513.
[16] Rossi S, Hallett M, Rossini PM, et al. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research[J]. Clin Neurophysiol,2009,120(12):2008—2039.
[17] Liepert J, Zittel S, Weiller C. Improvement of dexterity by single session low-frequency repetitive transcranial magnetic stimulation over the contralesional motor cortex in acute stroke: a double-blind placebo-controlled crossover trial[J]. Restor Neurol Neurosci,2007,25(5-6):461—465.
[18] 刘传玉,梅元武,张小乔. 经颅磁刺激对脑缺血大鼠功能恢复和健侧突触结构的影响[J].中华物理医学与康复杂志,2005,27(12):707—710.
·基础研究·
瞬时感受器电位离子通道4在大鼠背根神经节
持续受压后异常放电中的作用*
范真真1 曲玉娟1 魏 慧1 王永慧1 马剑锋2 岳寿伟1,3
摘要
目的:利用在体神经纤维电生理技术记录大鼠背根神经节(DRG)持续受压(CCD)后的异常放电情况,明确瞬时感受器电位离子通道4(TRPV4)是否参与了CCD后受损DRG的异常放电。
方法:制备大鼠DRG的CCD模型,分别于术前和术后测量损伤侧的机械痛阈和热辐射刺激缩爪反应潜伏期。利用在体神经纤维电生理技术分别记录正常组大鼠DRG及CCD组、CCD+钌红组、CCD+佛波醇组受损DRG神经元的异常放电情况。
结果:持续压迫明显降低大鼠损伤侧的机械痛阈和热辐射刺激缩爪反应潜伏期(n=30, P<0.05);CCD组可以记录到受损DRG神经元的异常放电,放电率约为67%,而正常组DRG的异常放电率约为4.5%;以TRP家族阻断剂钌红(ruthenium red, RR)100μm孵育受损DRG,较CCD组受损DRG神经元异常放电的频率和波幅均明显下降(n=10, P<0.05);以TRPV4特异性激动剂佛波醇(4α-phobol 12,13-didecanoate, 4α-PDD)10μm孵育受损DRG,较CCD组受损DRG异常放电频率和波幅均明显增加(n=10, P<0.05)。
结论:CCD后受损DRG可出现异常放电,TRPV4参与了CCD后受损DRG的异常放电。
关键词 异常放电;瞬时感受器电位离子通道4;背根神经节;持续压迫;电生理技术
中图分类号:R338.8, R745 文献标识码:A 文章编号:1001-1242(2013)---
The role of transient receptor potential vanilloid 4 in mediating the ectopic discharges following chronic compression of dorsal root ganglion in rats/ FAN Zhenzhen, QU Yujuan, WEI Hui, et al.// Chinese Journal of Rehabilitation Medicine, 2013, 28(3):
Abstract
Objective: To investigate the role of transient receptor potential vanilloid 4 (TRPV4) in mediating the ectopic discharges of the injured DRG with chronic compression.
Method: After CCD model was established, the mechanical withdrawal threshold and the thermal withdrawal latency were administered. The ectopic discharges of the normal DRG and the injured DRG were recorded by the nerve fibers electrophysiology in vivo.
Result: Mechanical withdrawal threshold and thermal withdrawal latency reduced significantly after CCD (n=30, P<0.05); The ectopic discharges were present in 67% of the fibers recorded from DRG neurons injured with chronic compression in contrast to 4.5% from uninjured DRG neurons; Compared with the CCD group the frequency and amplitude of the ectopic discharges were significantly decreased after incubating the injured DRG with 100μmRR, a TRP inhibitor (n=10, P<0.05); Compared with the CCD group the frequency and amplitude of the ectopic discharges were significantly increased after incubating the injured DRG with 10μm4α-PDD, a TRPV4 specific activator (n=10, P<0.05).
Conclusion: TRPV4 plays a crucial role in mediating the ectopic discharges of the injured DRG after CCD.
Author's address Department of Physical Medicine and Rehabilitation, Qilu Hospital of Shandong University, Medical School of Shandong University, Jinan, 250012
Key word ectopic discharge; transient receptor potential vanilloid 4; dorsal root ganglion; chronic compression; electrophysiological technique
腰背痛主要源于脊柱及其周围结构的异常,由小关节痛、椎间盘突出、椎管狭窄、肿瘤、感染、血管畸形及坐骨神经痛等引起[1]。背根神经节(dorsal root ganglion, DRG)在腰背痛的发病过程中起重要作用,各种损伤因素导致背根神经节持续受压(chronic compression of dorsal root ganglion, CCD)产生的根性神经痛是最常见致病原因[2]。DRG持续受压后可产生自发性疼痛、机械性的异常疼痛和热痛觉过敏,而且伴随着神经元的自发性放电增加,动作电位和电流阈值降低。受压的DRG成为异常放电的来源,即使无交感神经活动或者内源性化学激活物质,仍存在自发放电[3—5]。
背根神经节上的瞬时感受器电位离子通道(transient receptor potential vanilloid,TRPV)家族中的TRPV2及TRPV4都被认为与机械性疼痛有关[6—7],其中TRPV4的作用越来越受到关注。TRPV4是一种非选择性的外向整流阳离子通道,可以被温度、低渗透压、佛波醇酯、低pH等激活,被钌红及反义寡脱氧核苷酸(oligodeoxynucleotide, ODN)、SiRNA等抑制或阻断[8—9]。TRPV4对钙离子和钠离子都有通透性,钙钠的通透比值为5∶7,TRPV4受体激活后引起细胞内钠离子和钙离子浓度增加,异位放电增加[10]。TRPV4基因敲除的小鼠对伤害性压力刺激的回避反应降低,但对非伤害性触觉的反应正常[11],同时这类小鼠对热刺激不敏感[12]。以上文献报道提示在神经性疼痛和炎症性疼痛等不同的病理状态下,TRPV4可以介导多种原因引起的机械和热痛敏。
有报道称,通过膜片钳技术可以记录到离体的持续受压的DRG细胞出现异常放电,DRG细胞经(phorbol 12, 13-dibutyrate, PDBu)孵育后,在DRG细胞上可以记录到一显著增强的TRPV4电流[13]。因此,我们推测TRPV4可能与CCD后受损DRG的异常放电有关。本实验拟采用在体神经纤维电生理技术观察CCD后受损DRG异常放电情况及RR和4α-PDD对放电的影响,明确TRPV4是否参与了CCD后受损DRG的异常放电。
1 材料与方法
1.1 试剂与主要仪器
健康雄性Wistar大鼠35只,体重180—220g,由山东大学实验动物中心提供;常规试剂:氯化钠(NaCl)、氯化钾(KCl)、氯化钙(CaCl2)、氯化镁(MgCl2)、氢氧化钠(NaOH)、葡萄糖(Glucose)、戊巴比妥钠、液体石蜡等购自山东试剂厂;三羟甲基氨基甲烷(Tris)、佛波醇(4α-PDD)、钌红(RR)购自美国Sigma公司;BME-403型Von Frey机械痛刺激仪和BME-410A型热痛刺激仪由中国医学科学院生物医学工程研究所生产;BL-420E+生物机能实验系统购自成都泰盟科技有限公司。
1.2 背根神经节持续受压模型的制备与行为学测量
1.2.1 背根神经节持续受压模型的制备:腹腔注射戊巴比妥钠(50mg/kg)麻醉动物,消毒后进行手术。沿L4—S1脊柱右侧切开皮肤,钝性分离脊柱右侧肌肉至横突,暴露右侧L5—L6横突及其间的L5椎间孔。将一根L型钢棒(每侧长约4mm,直径0.63mm)插入椎间孔,以对右侧L5背根神经节及邻近神经根形成持续的压迫[3]。
1.2.2 机械痛阈和热痛痛阈的测量:①机械痛阈(mechanical withdrawal threshold)的测量:每次测试前让大鼠在铺有金属网格的透明玻璃箱里适应30min,然后采用一套标有固定刻度的Von Frey针丝刺激足心,刺激强度由小到大,逐渐增加。同一强度的Von Frey针丝对同一个足底刺激5次,每次刺激间隔为5min。如大鼠出现快速缩足或舔足,即为阳性反应。5次中有3次以上出现阳性反应(>60%)的最小刺激强度为该侧后足的机械痛阈。②热辐射刺激缩爪反应潜伏期(thermal withdrawal latency)的测量:每次测试前让大鼠在铺有6mm厚的有机玻璃板的透明玻璃箱里适应30min,当其安静且后爪接触玻璃板时,使热痛刺激仪的光源聚焦照射动物后肢足底掌心,电子秒表记录从照射开始到引起后肢回缩反应时的潜伏期作为热痛觉观测指标。读数精确到0.01s,取每只大鼠5次测量结果的均值为统计数据,测量间隔时间为5min。事先调节光照强度,使平均潜伏期约10s,上限为20s,以免造成组织损伤。
1.3 背根神经节异常放电的引导及记录
DRG持续受压后3—8d的大鼠,腹腔注射戊巴比妥钠(50mg/kg)将其麻醉,进行腰骶部椎板切开术,在L1—L2和L4—L5分别制备2个浴槽。在L4—L5浴槽内,充分暴露受压迫的L5背根神经节,并在其外周端5—10mm处切断脊神经,以中断外周感受器传入冲动,另外切断L5周围的交通支,以中断其他节段感觉的传入,并在该浴槽内加入35—37℃的人工脑脊液,其成分为:NaCl 150mmol/L,KCl 5mmol/L,MgCl2 1mmol/L,CaCl2 2mmol/L,Glucose 10mmol/L,Tris 5mmol/L,pH 7.4。在L1—L2浴槽内,分离与辨认连接受损DRG的L5背根神经,并用35—37℃的液体石蜡覆盖[3]。在显微镜下用精细制表镊从L5背根神经分离出直径约30—50μm的神经细束,将中枢端悬挂在铂金丝(直径25μm)引导电极上,参考电极插入附近的皮肤组织内,通过BL-420E+生物机能实验系统记录来自损伤DRG的异常放电[4]。
1.4 统计学分析
所测数据采用SPSS 17.0统计软件进行分析。采用配对样本t检验分析对照组与CCD组间机械痛阈、热辐射刺激缩爪反应潜伏期的差异,以及用药前后放电频率、放电波幅的变化。采用χ2检验分析对照组与CCD组间放电率的差异,所有结果采用均数±标准差表示。
2 结果
2.1 背根神经节持续受压后机械痛阈和热辐射刺激缩爪反应潜伏期
CCD明显降低机械痛阈和热辐射刺激缩爪反应潜伏期(见图1, P<0.05)。术后第1天机械痛阈开始下降,到第5—7天达到最低值,然后逐渐恢复,但直到术后28天,CCD组大鼠的机械痛阈仍明显低于正常对照组大鼠(见图1A, P<0.05)。热辐射刺激缩爪反应潜伏期的变化趋势与机械痛阈相似,CCD明显降低热辐射刺激缩爪反应潜伏期(见图1B, P<0.05)。
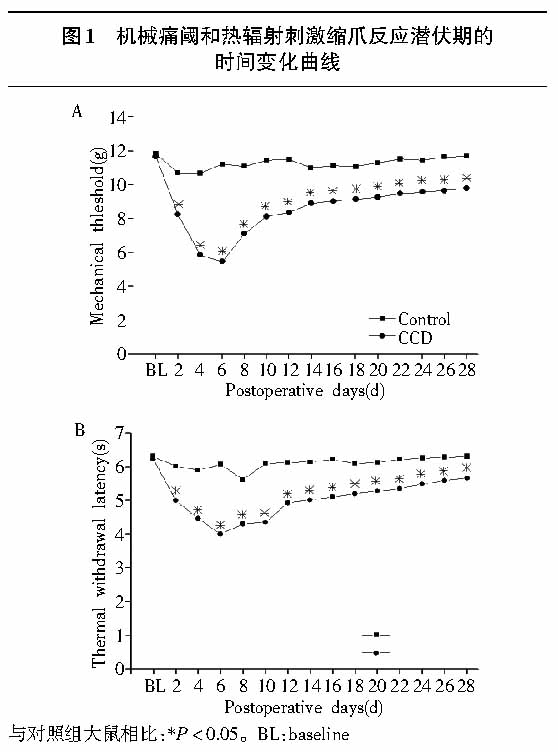
2.2 背根神经节持续受压后受损背根神经节神经元的异常放电
2.2.1 受损背根神经节的异常放电:大鼠背根神经节持续受压后3—8d,受损DRG异常放电的放电率明显升高(P<0.05),与报道一致[4]。实验观察了10例CCD模型大鼠,共记录到了42根神经束,其中28根异常放电阳性,放电率约为67%,所记录的放电波形波宽较窄,且峰峰间期比较稳定(见图2B)。在相同条件下实验观察了5例正常大鼠的DRG放电,共记录到了22根神经束,其中1根自发放电阳性,放电率约为4.5%,放电波形与异常放电相似。
2.2.2 钌红对受损背根神经节异常放电的影响:实验观察了10例CCD大鼠,共记录到了37根神经束,其中24根异常放电阳性的神经束对RR有反应。在L4—L5孵育槽内加入100μm RR孵育受损DRG,较加药前受损DRG异常放电频率和波幅均下降(P<0.05, 见表1),30min后神经放电几乎被完全阻断(见图3Ⅰ),用人工脑脊液冲洗后放电活动未恢复。
2.2.3 佛波醇对受损背根神经节异常放电的影响
实验观察了10例CCD大鼠,共记录到了40根神经束,其中26根异常放电阳性的神经束对4α-PDD有反应。根据文献报道[13],在L4—L5孵育槽内加入10μm的4α-PDD对受损DRG进行孵育,较加药前受损DRG异常放电频率和波幅均升高(P<0.05, 见表1),20min后异常放电达最大值且稳定(见图3Ⅱ)。

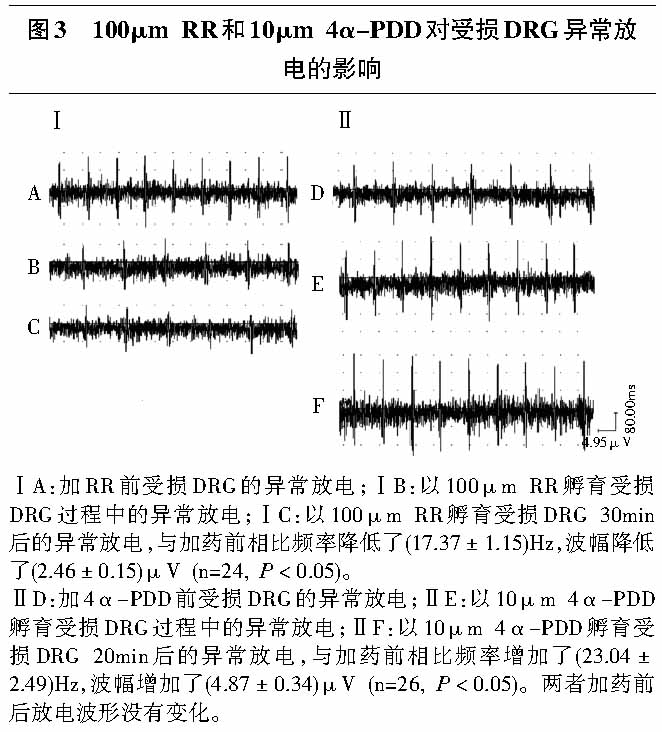
.jpg)
3 讨论
DRG作为感觉传入的第一级神经元,它的主要功能是对其支配的神经纤维起营养和支持作用,正常情况下,DRG神经元胞体既不直接传递电活动,也不直接产生自发放电[13]。当DRG及外周神经受损后,该神经元的生理功能会产生明显的改变,表现为兴奋性过高,体内微小的物理或化学变化的刺激都可导致神经损伤区或相应的感觉神经胞体大量持久地产生异常放电活动,进而出现自发疼痛、痛觉过敏及感觉异常等慢性神经病理痛症状,成为神经病理性痛的信号源[14]。
CCD模型中,椎间孔处插入的钢棒可对DRG产生机械压迫,使其缺血、水肿以及促进炎性因子的释放,进而提高受损DRG神经元的兴奋性,表现为电流阈值和动作电位阈的降低及自发性放电的增加[3,5]。DRG神经元的高兴奋性导致脊髓背角高兴奋性,进而产生痛敏和异常疼痛[15]。本实验通过建立CCD模型,采用在体神经纤维电生理技术记录受损DRG的放电的情况,发现受损DRG的异常放电率明显增加,而且CCD大鼠的机械痛阈和热辐射刺激缩爪反应潜伏期明显降低,与上述报道一致[3]。
本课题组前期研究结果显示,CCD可以明显增加受损DRG中TRPV4基因、蛋白的表达,并敏化TRPV4通道的功能。另外,TRPV4既是大鼠DRG中重要的机械感受器,又是DRG中重要的温度伤害性感受器,能够介导CCD导致的机械和热痛敏[16]。对大鼠海马神经元的研究显示,TRPV4是神经元兴奋性的重要调节因素[17]。所以,增加的TRPV4可能是CCD神经元高兴奋性的机制之一。许多试验已经证明,CCD可以提高DRG神经细胞的兴奋性,产生自发性放电和异位放电。所以,TRPV4可能是CCD后受损DRG产生异常放电的机制之一。
钌红是TRP家族的阻断剂,能抑制TRP通道的开放[18]。有报道称100μm钌红可以阻断89%的颈动脉窦压力感受器上的TRP通道,使其自发放电降低[9]。本研究以100μm钌红孵育受损DRG,发现受损DRG异常放电频率和波幅均明显下降,用人工脑脊液冲洗仍无恢复,与报道相一致。这提示TRP家族可能参与了受损DRG的异常放电过程。4α-PDD是一种非蛋白磷脂酶c途径激活通道的佛波脂类,对TRPV4有强效的特异性激动作用[13],激活TRPV4受体,使异位放电增加。10μm的4α-PDD可以显著升高受损DRG放电频率及波幅。以上两个结果提示TRP4可能参与了受损DRG的异常放电过程。
4 结论
CCD后受损DRG出现异常放电,TRPV4参与了CCD后受损DRG的异常放电过程。
参考文献
[1] Govind J. Lumbar radicular pain[J]. Aust Fam Physician, 2004, 33(6):409—412.
[2] Ma C, Greenquist KW, Lamotte RH. Inflammatory mediators enhance the excitability of chronically compressed dorsal root ganglion neurons[J]. J Neurophysiol, 2006, 95(4):2098—2107.
[3] Hu SJ, Xing JL. An experimental model for chronic compression of dorsal root ganglion produced by intervertebral foramen stenosis in the rat[J]. Pain, 1998, 77(1):15—23.
[4] Song XJ, Hu SJ, Greenquist KW, et al. Mechanical and thermal hyperalgesia and ectopic neuronal discharge after chronic compression of dorsal root ganglia[J]. J Neurophysiol, 1999, 82(6):3347—3358.
[5] Song XJ, Wang ZB, Gan Q, et al. cAMP and cGMP contribute to sensory neuron hyperexcitability and hyperalgesia in rats with dorsal root ganglia compression[J]. J Neurophysiol, 2006, 95(1):479—492.
[6] Alessandri-Haber N, Joseph E, Dina OA, et al. TRPV4 mediates pain-related behavior induced by mild hypertonic stimuli in the presence of inflammatory mediator[J]. Pain, 2005, 118(1—2):70—79.
[7] 岳寿伟.TRPV4在根性神经痛中的作用机制[J].中国康复医学杂志,2010,25(10):921—922.
[8] Gunthorpe MJ, Benham CD, Randall A, et al. The diversity in the vanilloid (TRPV) receptor family of ion channels[J]. Trends Pharmacol Sci, 2002, 23(4):183—191.
[9] 刘廷会,魏华,赵海燕,等.苄阿米洛利和钌红对颈动脉窦压力感受器放电的阻断作用[J].首都医科大学学报,2011,32(02):218—223.
[10] Nilius B, Watanabe H, Vriens J. The TRPV4 channel: structure-function relationship and promiscuous gating behaviour[J]. Pflugers Arch, 2003, 446(3):298—303.
[11] Suzuki M, Mizuno A, Kodaira K, et al. Impaired pressure sensation in mice lacking TRPV4[J]. J Biol Chem, 2003, 278(25):22664—22668.
[12] Todaka H, Taniguchi J, Satoh J, et al. Warm temperature-sensitive transient receptor potential vanilloid 4 (TRPV4) plays an essential role in thermal hyperalgesia[J]. J Biol Chem, 2004, 279(34):35133—35138.
[13] Cao DS, Yu SQ, Premkumar LS. Modulation of transient receptor potential Vanilloid 4-mediated membrane currents and synaptic transmission by protein kinase C[J]. Molecular Pain, 2009, (5):5.
[14] 李云庆,陈军,胡三觉.神经病理性痛模型的创建及其在镇痛机制和治疗研究中的应用[J].中国疼痛医学杂志,2010,16(04):236—237.
[15] Zhang Y, Wang YH, Ge HY, et al. A transient receptor potential vanilloid 4 contributes to mechanical allodynia following chronic compression of dorsal root ganglion in rats[J]. Neuroscience Letters, 2008, 432(3):222—227.
[16] 张杨,王永慧,丁欣利,等.TRPV4在介导大鼠背根神经节持续受压后机械和热痛敏中的作用[J].中国康复医学杂志,2010,25(12):1123—1130.
[17] Shibasaki K, Suzuki M, Mizuno A, et al. Effects of body temperature on neural activity in the hippocampus: regulation of resting membrane potentials by transient receptor potential vanilloid 4[J]. J Neurosci, 2007, 27(7):1566—1575.
[18] Bobkov YV, Ache BW. Pharmacological properties and functional role of a TRP-related ion channel in lobster olfactory receptor neurons[J]. J Neurophysiol, 2005, 93(3):1372—1380.